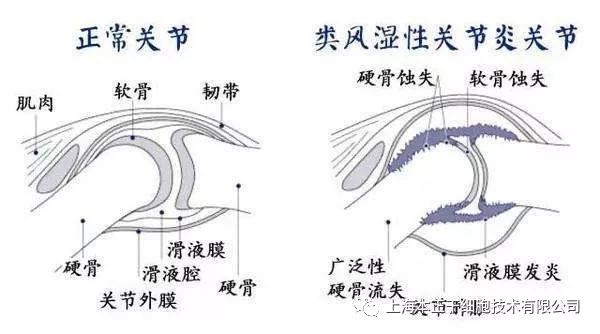
类风湿关节炎——号称“不死的癌症”。类风湿关节炎(rheumatoid arthritis,RA),是一种慢性自身免疫性炎症性关节病,以关节持续滑膜炎和全身炎症为特征。主要病理机制在于涉及多种免疫细胞的异常激活,导致持续慢性炎症;炎症刺激成纤维细胞样滑膜细胞(FLS)具有侵袭性,可导致关节损伤和破骨细胞活性增强介导过度的骨吸收[1, 2]。



因此,一个具有挑战性的目标是:通过永久免疫耐受诱导炎症缓解,防止关节结构持续恶化,并修复现有损伤。

RA患者的骨髓CD34+细胞数量较少,具有缺陷的克隆形成潜能,而且体内肿瘤坏死因子-α(TNF-α)能加剧骨髓干细胞的损伤[3]。循环造血干/祖细胞(HSPC)也减少,大约10-15%的HSPC表现为增殖障碍,出现定向细胞分化障碍,同时伴随着端粒长度变短[4, 5]。
一个涉及15个临床中心76名难治性RA患者的临床研究显示,干细胞移植治疗难治性RA有较好的耐受性,并在短期内取得相当积极的反应。大多数患者有显著的反应,超过50%的患者在12个月内达到了美国风湿病学会的50%的改善(ACR50);健康评估问卷(HAQ)在18个月内显著减少;与RF阳性患者相比,RF阴性患者对HSCT有更良好的反应。然而,大多数患者在6个月后出现了疾病发作[6]。即使纯化自体造血干细胞后再进行移植,也同样面临着大多数RA患者复发的问题[7]。
这说明:干细胞治疗RA患者的长期疗效不好,可能患者局部存在一些影响干细胞正常分化为免疫细胞的因素。因此,可以采用异体健康的干细胞移植治疗难治性RA[8]。

动物实验研究提示,MSCs治疗RA的机制包括:
-
降低血清中炎性细胞因子和趋化因子的浓度;
-
减少抗原特异性Th1/Th17的增殖,转移淋巴结和关节中的Th1/Th2类反应;
-
诱导抗原特异性CD4+CD25+Foxp3+T细胞(Treg细胞)或TR1(IL-10+CD4+)细胞的产生;
-
抑制成纤维细胞样滑膜细胞(Flss)和破骨细胞的活化。
在RA患者中,MSCs能抑制免疫反应,同时促进调节性T细胞(Treg)的增殖[11]。成纤维细胞样滑膜细胞(Flss)和破骨细胞的活化也参与了RA的发病机制。MSCs也能抑制FLSS的增殖、侵袭和炎性因子的分泌[12, 13]。MSCs对NFκB配体的受体激活剂诱导的破骨细胞分化有很强的抑制作用[14]。MSCs还能抑制RA患者的巨噬细胞的极化,使巨噬细胞从炎症类型转变为抗炎类型,从而改善局部炎症微环境[15]。
但是RA患者骨髓MSCs的增殖能力、迁移能力、免疫抑制能力和表达分泌血管内皮生子因子的量均有所下降[16, 17]。RA患者骨髓MSCs的增殖潜能降低与端粒长度过早丢失有关[16]。RA患者骨髓MSCs因低表达CCL2蛋白而导致MSCs的免疫抑制功能受损[17]。因此,异体健康的MSCs成为治疗RA的必然选择。

136例活动期RA患者除接受DMARDs外,静脉注射UC-MSCs(每人4千万个MSCs,1-2次),与对照组36例(DMARDs治疗组)相比,均有明显的临床改善;疗效维持3~6个月,且与外周血中Tregs比例增高相关[11]。在这个研究中,发现外周血Treg细胞的数量可以作为疗效的客观指标之一,Treg细胞的数量恢复到正常或者接近正常水平,RA的症状缓解就较明显。
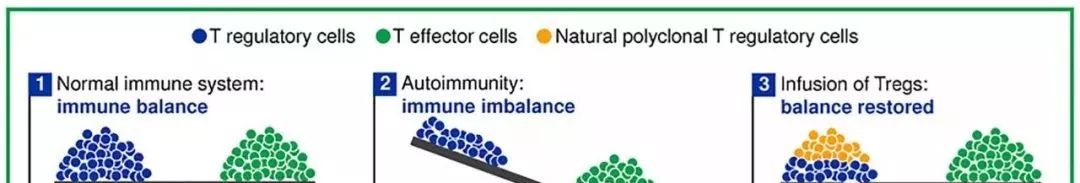
Treg细胞在免疫系统中非常重要,能维持免疫平衡和诱导免疫耐受。如果Treg细胞数量减少,不能限制效应性T细胞的攻击性,导致不能维持免疫平衡,那么将出现自身免疫性疾病。如果额外补充Treg细胞或者促进Treg细胞的增殖,使免疫重新恢复平衡,则不出现自身免疫疾病(见图)。

2018年韩国报道脐血来源的MSCs治疗9名RA患者的Ia期临床试验,单次静脉注射2千5百万、5千万、1亿三个剂量,治疗4周后,9名RA患者的DAS28-ESR评分从4.53±1.35降到2.93±1.22、疼痛VAS评分从64.8±20.2降到46.9±29.1;而且最高MSCs剂量组的炎症因子下降最明显[21]。
在蛋白多糖诱导的关节炎小鼠关节内注射荧光素酶转染MSCs,根据生物发光成像显示,MSCs在关节内滞留最多4-5周,但是没在关节腔外观察到MSCs[22]。这说明MSCs在关节腔内能被机体关节组织所清除,这也提示需要反复多次注射才能维持疗效。


综上所述,健康干细胞(HSCs)和间充质干细胞(MSCs)均是治疗难治性RA的一种相对安全有效的方法。基于MSCs具有较强的免疫调节能力和较低的免疫原性,更适合于难治性RA患者的治疗。

