2025年10月8日,“干细胞宣传日”正式到来。在这个具有里程碑意义的日子,一个充满希望的图景愈发清晰:干细胞正化身为“活体药物”,在对抗众多难治性疾病的战场上释放巨大能量。
这并非遥不可及的科学幻想,而是建立在对生命核心单元——细胞的深度研究与精准运用之上,正逐步照进现实的医学突破。
2025 年 10 月 8 日,《Stem Cell Research & Therapy》编委会在“干细胞认知日”发布社论《Stem cells as biological drugs for incurable diseases》干细胞作为治疗不治之症的生物药物。
这篇文章提出一个颇具转折意义的观点:
干细胞不只是研究对象,而是一种“活的药”(living drug)。
这意味着医学正从“控制症状”走向“修复结构”。
为什么说干细胞是“活药”?
传统药物在体内遵循“吸收—分布—代谢—排泄”的轨迹,像一次性工具。
而干细胞不同,它是活的治疗单元:
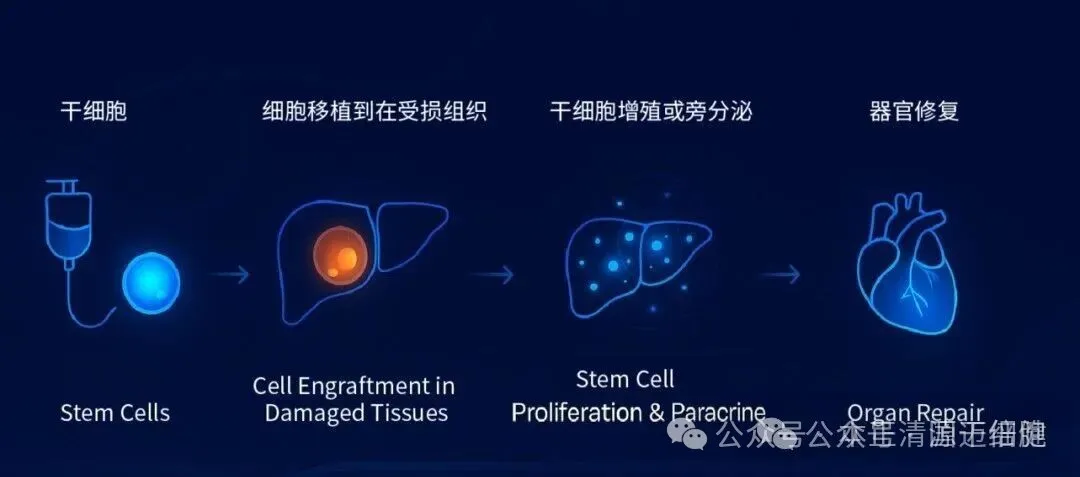
能识别损伤信号、迁移到病灶、调节免疫、修复组织,有机会在结构层面带来持久改善。
社论指出,越来越多研究显示,这类“活药”在神经系统、心血管、免疫疾病、肝脏纤维化等多领域都已见到功能改善信号。
哪些疾病最有希望从“活药”受益?
对于那些无法通过传统疗法治愈的疾病患者而言,“干细胞研究与治疗” 为他们带来了新的希望。
这些疾病包括:
这些疾病往往无法逆转,只能通过药物控制症状或延缓进展。传统治疗通常带来的是暂时缓解,无法从根本上恢复受损组织功能。而随着人口老龄化加速,这类慢性疾病的发病率持续攀升,对个人与医疗体系造成巨大压力。
在这种背景下,干细胞疗法与再生医学被认为是当代医学最具潜力的下一代治疗策略。它们的目标是:“修复、替代或再生受损组织,从细胞层面恢复生理功能。”
干细胞的核心特性与分类
干细胞具有两大定义性特征:
然而,并非所有干细胞都具有相同的潜力,这主要取决于它们的来源和发育阶段。
胚胎干细胞(ESCs):具有多能性,意味着它们可分化为人体内所有类型的细胞,包括外胚层细胞(如皮肤细胞、神经细胞)、中胚层细胞(如肌肉细胞、血细胞)和内胚层细胞(如肝细胞、胰腺细胞)。这一特性使胚胎干细胞在研究与治疗应用中极具潜力,但对其的使用仍涉及严重的伦理、监管及安全性问题。
成体(或体细胞)干细胞:例如造血干细胞(HSCs,存在于骨髓中)和间充质干细胞(MSCs,存在于脐带等多种成体组织中),其增殖与分化能力相对有限。这类干细胞通常具有多能性(注:此处 “多能性” 与胚胎干细胞的 “多能性” 含义不同,特指可分化为与其来源组织相关的有限几种细胞类型)。
诱导多能干细胞(iPSCs):是通过基因重编程使成体细胞具备胚胎干细胞特性的细胞类型。与胚胎干细胞类似,诱导多能干细胞也具有多能性,可分化为人体内任何一种细胞类型,为个性化医疗提供了极具前景的替代方案,且不存在胚胎来源相关的伦理问题,但仍存在潜在的致瘤性风险。
六种核心机制,决定疗效差异
干细胞发挥作用的六种机制,就像六个修复通道:
分化替代:补上缺失细胞(如帕金森中的多巴胺神经元前体);
旁分泌调控:释放生长因子,改善局部微环境;
免疫调节:降低炎症反应,恢复耐受;
归巢迁移:沿损伤信号找到病灶;
植入整合:与组织连接形成长期作用;
抗凋亡/抗纤维化:保护濒危细胞,减缓瘢痕化。
研发设计、疗效评估与终点设定,都应围绕这些机制展开,避免“一套指标打天下”。
干细胞疗法:重新定义再生医学的未来
以下仅列举几个例子,展示干细胞如何通过治愈当前无法医治的疾病,为再生医学领域带来革命性变革。这些案例中,干细胞被用作实验性疗法,相关治疗方案目前仍处于评估阶段。这些研究仍处于临床评估阶段,属于实验性治疗,但已展现出令人振奋的疗效信号。
多发性硬化症(MS):近期研究显示,干细胞可用于治疗对常规疗法无反应的多发性硬化患者。该疗法通过“重启”患者的免疫系统,从而阻止疾病进展,甚至逆转部分神经损伤。
糖尿病:干细胞疗法也被用于制造能分泌胰岛素的β细胞,有望让糖尿病患者摆脱终身胰岛素注射。部分生物技术公司开发的包封β细胞在临床试验中已显示出持续分泌胰岛素的能力,未来有望减少甚至消除对外源胰岛素的依赖。
心力衰竭:在心脏病学领域,研究人员正在探索通过干细胞修复受损心肌。这一曾被认为不可逆的损伤,如今在实验中已显示出心功能改善、瘢痕缩小、生活质量提升等积极结果。
帕金森病:在帕金森病的治疗中,研究者将多能干细胞分化为多巴胺能神经元并输入患者脑内。来自欧洲与日本的早期临床试验显示,这种疗法能带来多巴胺神经修复与运动功能改善的新希望。
肝功能衰竭:科学家正在利用干细胞构建类肝器官(Liver Organoids),以替代终末期肝衰竭患者的肝移植需求,减少器官短缺问题。
骨关节炎:间充质干细胞(MSC)被用于治疗老年性骨关节炎。研究显示,这种疗法可抑制炎症、促进软骨再生,为传统关节置换手术提供了更微创的替代方案。
这些干细胞治疗的早期结果不仅令人鼓舞,更可能具有革命性意义。虽然距离全面临床应用仍需时间,但干细胞疗法无疑正在重塑现代医学的格局。
干细胞从“可行”走向“可及”的三道门槛
1. 安全与伦理|先守底线,再谈突破
要让“活药”真正落地,安全永远是第一道关。防止免疫排斥和异常增殖,建立长期随访和透明追踪,让研究、监管、患者都在同一条安全线上。
2. 标准与一致|好结果要能复制
从供体筛选到制备质控,每一步都要有章可循。只有标准化,才谈得上可重复、可验证,让不同中心的研究能对接,疗效更可信。
3. 制造与可及|从工厂到病床
“活药”不是实验室样品,而是要能批量送达的治疗。细胞要活得稳、运得远,还要让更多人用得起。工程、监管和支付体系,缺一不可。
社论提醒,干细胞的“活药化”,不只是科学突破,更是一场安全、标准、可及的三重考验。

结语:从控制到重建,医学的下一步
干细胞不仅能延长寿命、改善生活质量,更改变了我们对疾病治疗的根本认知与决策方式。
“活的药物”这一理念,标志着医学从化学药物向生物细胞治疗的转型。干细胞不再只是控制症状,而是可能从根本上修复与再生组织。
干细胞研究与治疗代表了未来的个体化、精准化与潜在治愈性医学“不可治愈”这一词汇,正因干细胞的进步而逐渐淡出医学词典。然而,只有当创新与责任并行,这份承诺才能真正实现。
|
